Nukleinsäure von Mycobacterium tuberculosis und Rifampicin(RIF)-Resistenz(INH)
Produktname
HWTS-RT147 Mycobacterium Tuberculosis Nukleinsäure und Rifampicin (RIF), (INH) Nachweiskit (Schmelzkurve)
Epidemiologie
Mycobacterium tuberculosis, kurz Tuberkelbazillus (TB), ist das pathogene Bakterium, das Tuberkulose verursacht. Zu den derzeit gebräuchlichen Tuberkulosemedikamenten der ersten Wahl gehören Isoniazid, Rifampicin und Ethambutol.[1]Aufgrund der unsachgemäßen Anwendung von Tuberkulosemedikamenten und der besonderen Eigenschaften der Zellwandstruktur von Mycobacterium tuberculosis selbst hat das Bakterium jedoch Resistenzen gegen diese Medikamente entwickelt. Eine besonders gefährliche Form ist die multiresistente Tuberkulose (MDR-TB), die gegen die beiden gängigsten und wirksamsten Medikamente, Rifampicin und Isoniazid, resistent ist.[2].
Das Problem der Tuberkulose-Medikamentenresistenz besteht in allen von der WHO untersuchten Ländern. Um Tuberkulosepatienten präzisere Behandlungspläne anbieten zu können, ist es notwendig, Resistenzen gegen Tuberkulosemedikamente, insbesondere Rifampicin-Resistenzen, zu erkennen. Dies ist zu einem von der WHO empfohlenen diagnostischen Schritt bei der Behandlung von Tuberkulose geworden.[3]Obwohl die Entdeckung einer Rifampicinresistenz nahezu gleichbedeutend mit der Entdeckung einer MDR-TB ist, werden Patienten mit monoresistenter INH (Resistenz gegen Isoniazid, aber Sensitivität gegen Rifampicin) und monoresistenter Rifampicin (Sensitivität gegen Isoniazid, aber Resistenz gegen Rifampicin) allein durch den Nachweis einer Rifampicinresistenz nicht erfasst. Dies kann dazu führen, dass Patienten einer unangemessenen Erstbehandlung unterzogen werden. Daher sind Resistenztests gegen Isoniazid und Rifampicin in allen Programmen zur Bekämpfung von resistenter Tuberkulose (DR-TB) unerlässlich.[4].
Technische Parameter
| Lagerung | ≤-18℃ |
| Haltbarkeit | 12 Monate |
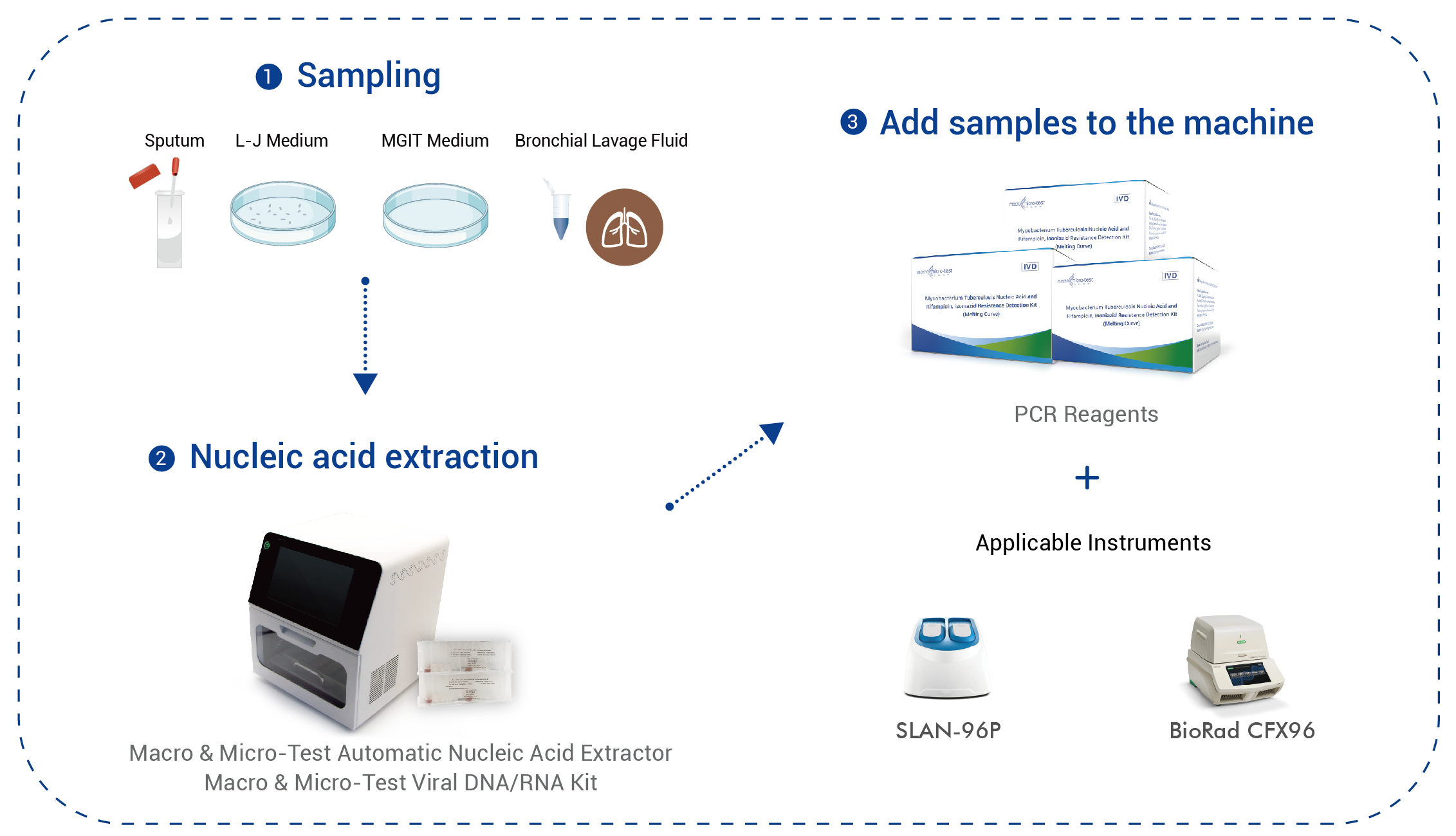
| Probenart | Sputumprobe, Festkultur (LJ-Medium), Flüssigkultur (MGIT-Medium) |
| CV | <5,0 % |
| LoD | Die Nachweisgrenze (LoD) des Kits zum Nachweis von Mycobacterium tuberculosis beträgt 10 Bakterien/ml;Die Nachweisgrenze (LoD) des Kits zum Nachweis von Rifampicin-Wildtyp und -Mutanten beträgt 150 Bakterien/ml. Die Nachweisgrenze (LoD) des Kits zum Nachweis von Isoniazid-Wildtyp und -Mutanten beträgt 200 Bakterien/ml. |
| Spezifität | 1) Es gibt keine Kreuzreaktion bei der Verwendung des Kits zum Nachweis von humaner genomischer DNA (500 ng), anderen 28 Arten von Atemwegserregern und 29 Arten von nichttuberkulösen Mykobakterien (siehe Tabelle 3).2) Es gibt keine Kreuzreaktion bei der Verwendung des Kits zum Nachweis der Mutationsstellen anderer arzneimittelresistenter Gene von Rifampicin- und Isoniazid-empfindlichen Mycobacterium tuberculosis (siehe Tabelle 4).3) Häufig vorkommende Störsubstanzen in den zu testenden Proben, wie z. B. Rifampicin (9 mg/L), Isoniazid (12 mg/L), Ethambutol (8 mg/L), Amoxicillin (11 mg/L), Oxymetazolin (1 mg/L), Mupirocin (20 mg/L), Pyrazinamid (45 mg/L), Zanamivir (0,5 mg/L) und Dexamethason (20 mg/L), haben keinen Einfluss auf die Testergebnisse des Kits. |
| Anwendbare Instrumente | SLAN-96P Echtzeit-PCR-Systeme (Hongshi Medical Technology Co., Ltd.), BioRad CFX96 Echtzeit-PCR-System |
Gesamt-PCR-Lösung