29 Mutationen des menschlichen EGFR-Gens
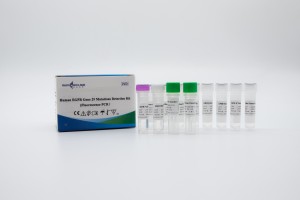
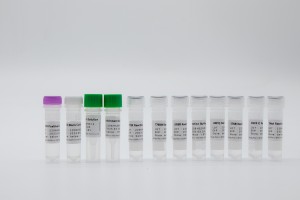
Produktname
HWTS-TM0012A-Kit zum Nachweis von Mutationen im humanen EGFR-Gen (Fluoreszenz-PCR)
Epidemiologie
Lungenkrebs ist weltweit die häufigste Krebstodesursache und stellt eine ernsthafte Bedrohung für die menschliche Gesundheit dar. Nicht-kleinzelliger Lungenkrebs (NSCLC) betrifft etwa 80 % aller Lungenkrebsfälle. Der EGFR (Elastase-stimulierende Proteinrezeptor) ist derzeit das wichtigste molekulare Zielmolekül für die Behandlung von NSCLC. Die Phosphorylierung des EGFR kann das Tumorwachstum, die Differenzierung, die Invasion, die Metastasierung und die Apoptose von Tumorzellen fördern sowie die Tumorangiogenese begünstigen. EGFR-Tyrosinkinase-Inhibitoren (TKI) blockieren den EGFR-Signalweg durch Hemmung der EGFR-Autophosphorylierung. Dadurch hemmen sie die Proliferation und Differenzierung von Tumorzellen, fördern die Apoptose von Tumorzellen und reduzieren die Tumorangiogenese, um so eine zielgerichtete Tumortherapie zu ermöglichen. Zahlreiche Studien haben gezeigt, dass die therapeutische Wirksamkeit von EGFR-TKI eng mit dem Mutationsstatus des EGFR-Gens zusammenhängt und dass sie das Wachstum von Tumorzellen mit EGFR-Genmutationen spezifisch hemmen können. Das EGFR-Gen befindet sich auf dem kurzen Arm von Chromosom 7 (7p12), ist 200 kb lang und besteht aus 28 Exons. Die mutierte Region liegt hauptsächlich in den Exons 18 bis 21. Die Deletionsmutation der Codons 746 bis 753 in Exon 19 ist für etwa 45 % der Mutationen verantwortlich, die L858R-Mutation in Exon 21 für etwa 40–45 %. Die NCCN-Leitlinien zur Diagnose und Behandlung von nicht-kleinzelligem Lungenkrebs (NSCLC) schreiben eindeutig vor, dass vor der Gabe von EGFR-TKI eine EGFR-Genmutationsanalyse durchgeführt werden muss. Dieser Test dient der Steuerung der EGFR-TKI-Therapie und bildet die Grundlage für eine personalisierte Medizin bei NSCLC-Patienten. Er ist ausschließlich für den Nachweis häufiger Mutationen im EGFR-Gen bei NSCLC-Patienten bestimmt. Die Testergebnisse dienen lediglich als klinische Referenz und sollten nicht als alleinige Grundlage für die individuelle Behandlung von Patienten herangezogen werden. Ärzte sollten den Zustand des Patienten, die Indikationen für die Medikamente und die laufende Behandlung berücksichtigen. Die Reaktion und andere Laborparameter sowie weitere Faktoren werden zur umfassenden Beurteilung der Testergebnisse herangezogen.
Kanal
| FAM | IC-Reaktionspuffer, L858R-Reaktionspuffer, 19del-Reaktionspuffer, T790M-Reaktionspuffer, G719X-Reaktionspuffer, 3Ins20-Reaktionspuffer, L861Q-Reaktionspuffer, S768I-Reaktionspuffer |
Technische Parameter
| Lagerung | Flüssig: ≤-18 °C im Dunkeln; Gefriergetrocknet: ≤30 °C im Dunkeln |
| Haltbarkeit | Flüssig: 9 Monate; Gefriergetrocknet: 12 Monate |
| Probenart | Frisches Tumorgewebe, Gefrierschnitt, in Paraffin eingebettetes pathologisches Gewebe oder Gewebeschnitt, Plasma oder Serum |
| CV | <5,0 % |
| LoD | Die Detektion von Nukleinsäure-Reaktionslösungen unter dem Hintergrund von 3 ng/μL Wildtyp kann eine Mutationsrate von 1 % stabil nachweisen. |
| Spezifität | Es besteht keine Kreuzreaktivität mit humaner Wildtyp-Genom-DNA und anderen Mutanten. |
| Anwendbare Instrumente | Applied Biosystems 7500 Echtzeit-PCR-SystemeApplied Biosystems 7300 Echtzeit-PCR-Systeme QuantStudio® 5 Echtzeit-PCR-Systeme LightCycler® 480 Echtzeit-PCR-System BioRad CFX96 Echtzeit-PCR-System |